È sempre più vicina la scadenza del 9 febbraio, ultimo giorno utile perché l’Italia ottemperi ai propri doveri di Stato membro dell’Ue e recepisca la direttiva sulla serializzazione che allarga al nostro Paese il sistema europeo di targatura dei farmaci (con codice univoco datamatrix). Il decreto legislativo che dovrebbe assolvere a tale funzione ha già raccolto da tempo i pareri di rito (commissioni parlamentari più Regioni) e attende soltanto il via libera finale del Governo. Che però continua a temporeggiare anche se ha ribadito più volte che l’intenzione è quella di rispettare la scadenza.
Il decreto in attesa di approvazione
Se in molti sono convinti che alla fine il decreto uscirà sul filo di lana ma uscirà, nessuno invece vuole sbilanciarsi a prevedere cosa accadrà dopo. Di sicuro, occorreranno diversi mesi per veder circolare i primi farmaci con il datamatrix stampato sulla confezione al posto dei bollini adesivi del Poligrafico: senza decreto, infatti, non possono essere emanate le disposozioni tecniche, e senza disposizioni tecniche non si possono rifare gli imianti dei nuovi packaging, che poi prima di essere stampati devono ricevere l’approvazione dell’Aifa.
Un avvio solo formale
Non è che tutto debba essere assolutamente pronto per il 9 febbraio: nella bozza finale circolata prima di Natale (l’ultima, a quanto è dato sapere al momento), il decreto stabilisce che i farmaci i cui lotti sono stati rilasciati prima di tale data (e quindi viaggiano nelle vecchie confezioni con bollino adesivo) possono continuare a circolare fino alla scadenza, senza la necessità di riconfezionamenti o rietichettature. Dunque, il 9 ci si potrà accontentare anche di un “via” solo formale. Non a caso, da tempo le aziende farmaceutiche hanno intensificato la loro produzione per costituire riserve adeguate con cui tirare avanti sino a quando saranno autorizzate e pronte le nuove confezioni con datamatrix. Ma resta pur sempre una corsa contro il tempo: secondo alcune stime ufficiose, ci sarebbero scorte sufficienti a coprire la domanda sino a settembre, dopo di che o arrivano i nuovi lotti oppure ci saranno crescenti carenze.
Distributori e farmacie in attesa
Anche distributori e farmacie stanno più o meno come l’industria, e cioè appesi a un filo. Senza le direttive tecniche, infatti, hardware e software (cioè lettori di codici e gestionali) non possono essere aggiornati, anche se è evidente che nulla cambia finché gireranno le confezioni con bollino. Più che altro, si fa strada la consapevolezza che, quando si partirà, andranno messi in conto un po’ di problemi di “taratura”. A dirlo è l’esperienza che arriva dai Paesi Ue dove il datamatrix è già stato adottato, come Germania e Francia.
Le esperienze di Germania e Francia
«I primi mesi di operatività sono stati difficili per le farmacie» ha confermato Benjamin Rohrer, responsabile comunicazione dell’Abda (l’associazione delle farmacie e dei farmacisti tedeschi) nel suo intervento a Scanner Orizzonti del 13 dicembre «si sono registrati problemi soprattutto nei collegamenti con il database dei codici univoci (detto anche Nmvs, ndr) e nella verifica degli stessi codici: nel primo mese di attività, il 5% delle confezioni scansionate dalle farmacie non venivano riconosciute dal sistema, come se si trattasse di scatole contraffatte. Gli allarmi però sono calati velocemente: già alla fine di quell’anno, il 2019, davano un falso positivo solo lo 0,42% delle confezioni. Quest’anno, l’incidenza è calata ulteriormente e non è andata oltre lo 0,07%».
Diverse le cause di questi falsi allarmi: «Può capitare che, senza accorgersi, il farmacista scannerizzi due volte la confezione» ha spiegato Rohrer «quindi l’annulla (si chiama decommissioning, nel gergo della targatura europea, ndr) e quando la dispensa la scatola risulta già uscita. Altro inconveniente, gli scanner delle farmacie possono fare fatica a leggere i codici datamatrix, oppure hanno problemi di connessione con il gestionale o il gestionale con il database dei codici. Può anche succedere che l’azienda produttrice, cui spetta l’immissione delle targhe nel sistema (commissioning, ndr) faccia errori nella registrazione. Ma la maggio parte degli inconvenienti, abbiamo visto, sono responsabilità delle farmacie».
Stesse evidenze dalla Francia: a novembre, scrive la rivista Le Moniteur des Pharmacies, il tasso degli alert nelle farmacie oscillava tra lo 0,2 e lo 0,3%, a fronte di un obiettivo dello 0,05%. Secondo France Mvo (l’ente nazionale che sovrintende alla banca dati dei codici, anche l’Italia ha il suo), la maggior parte di queste allerte è causata da problemi informatici. In particolare, si contano circa 400 farmacie che utilizzano ancora scanner incompatibili con il datamatrix o configurati in modo errato, da cui errori nella lettura dei numeri di lotto e di serie.
Ma la Francia rappresenta un caso da seguire anche per altre ragioni: per cominciare, il passaggio alla targatura europea è avvenuto con grande ritardo rispetto alle scadenze imposte dalla direttiva Ue (più di un anno dopo il febbraio 2019); in secondo luogo, la transizione è di fatto ancora in corso: secondo gli ultimi dati, solo il 75% delle confezioni dispensate viene verificato e “decommissionato”, perché ci sono ancora più di 900 farmacie (tra territoriali e ospedaliere) che ancora non risultano operative sulla piattaforma France Mvs, e quindi non annullano i codici delle confezioni che dispensano. Per ora l’Ue non ha inflitto sanzioni, ma per la stampa transalpina sarebbero nell’aria.
Un avvio graduale, ma le sanzioni sono pesanti
Per queste e altre ragioni, è una buona notizia che nel decreto legislativo in attesa di approvazione sia stata recepita la richiesta della filiera di concedere un avvio “soft” del nuovo sistema: «Dal 9 febbraio 2025 all’8 febbraio 2027» recita la bozza del d.lgs «è previsto un periodo di stabilizzazione per le operazioni di verifica, disattivazione e riattivazione dell’identificativo univoco, secondo le istruzioni operative definite dal Ministero della salute». Nessun rinvio sulle confezioni dunque, invece su commissioning, verifiche e decommissioning ci saranno 24 mesi di “indulgenza”.
Accontentati anche i distributori, che chiedevano l’esclusione dagli obblighi della tracciatura di passaggi intrasocietari (cioè tra grossisti dello stesso gruppo o società consortili) e flussi della dpc. Nessuna concessione, invece, sulle sanzioni, che rimangono in sostanza le stesse (pesanti) della prima bozza di decreto. Eccole:
| Violazione | Sanzione Amministrativa | Soggetti |
| Mancata apposizione sull’imballaggio di un medicinale di un identificativo univoco conforme alle specifiche tecniche. | Da €10.000 a €60.000 | Fabbricante |
| Inclusione di informazioni diverse dall’identificativo univoco nel codice a barre bidimensionale senza autorizzazione AIFA. | Da €10.000 a €60.000 | Fabbricante |
| Immissione o mantenimento in commercio di un medicinale privo del sistema di prevenzione delle manomissioni. | Da €10.000 a €60.000 | Titolare AIC |
| Mantenimento o immissione in commercio di un medicinale sottoposto a identificativo univoco privo del dispositivo antimanomissione. | Da €10.000 a €60.000 | Titolare AIC |
| Mancata verifica sull’autenticità dell’identificativo univoco o sull’integrità del sistema di prevenzione delle manomissioni. | Da €15.000 a €80.000 | Fabbricante, Grossista, Farmacia |
| Distribuzione o fornitura di un medicinale con identificativo univoco disattivato fuori dai casi consentiti. | Da €20.000 a €80.000 | Chiunque |
| Mancata disattivazione dell’identificativo univoco nei casi previsti dal regolamento. | Da €20.000 a €80.000 | Fabbricante, Grossista, Farmacia |
| Riattivazione di un identificativo univoco disattivato fuori dai casi consentiti. | Da €30.000 a €140.000 | Fabbricante, Grossista, Farmacia |
| Immissione sul mercato o esportazione di un medicinale con sospetta manomissione dell’imballaggio o falsificazione. | Da €30.000 a €140.000 | Fabbricante, Grossista, Farmacia |
| Mancata informazione immediata alle autorità competenti di sospetta manomissione o falsificazione di un medicinale. | Da €20.000 a €80.000 | Fabbricante, Grossista, Farmacia |
| Violazione delle disposizioni sulla disattivazione degli identificativi univoci. | Da €30.000 a €80.000 | Titolare AIC, Responsabile dell’immissione sul mercato (importazione/distribuzione parallela) |
| Violazione delle disposizioni relative agli adempimenti su prodotti revocati, ritirati o rubati. | Da €30.000 a €140.000 | Titolare AIC, Responsabile dell’immissione sul mercato (importazione/distribuzione parallela) |
| Violazione delle disposizioni sulla rimozione degli identificativi univoci dal sistema di archivi. | Da €5.000 a €30.000 | Titolare AIC, Responsabile dell’immissione sul mercato (importazione/distribuzione parallela) |
| Mancata conservazione o fornitura dei dati relativi alle operazioni sugli identificativi univoci alle autorità competenti. | Da €10.000 a €60.000 | Fabbricante |
| Mancata registrazione dell’identificativo univoco in fase di dispensazione del medicinale su ricetta dematerializzata. | €150 per ogni comunicazione (fino a un massimo di €60.000) | Farmacia |
Verso una transizione complessa
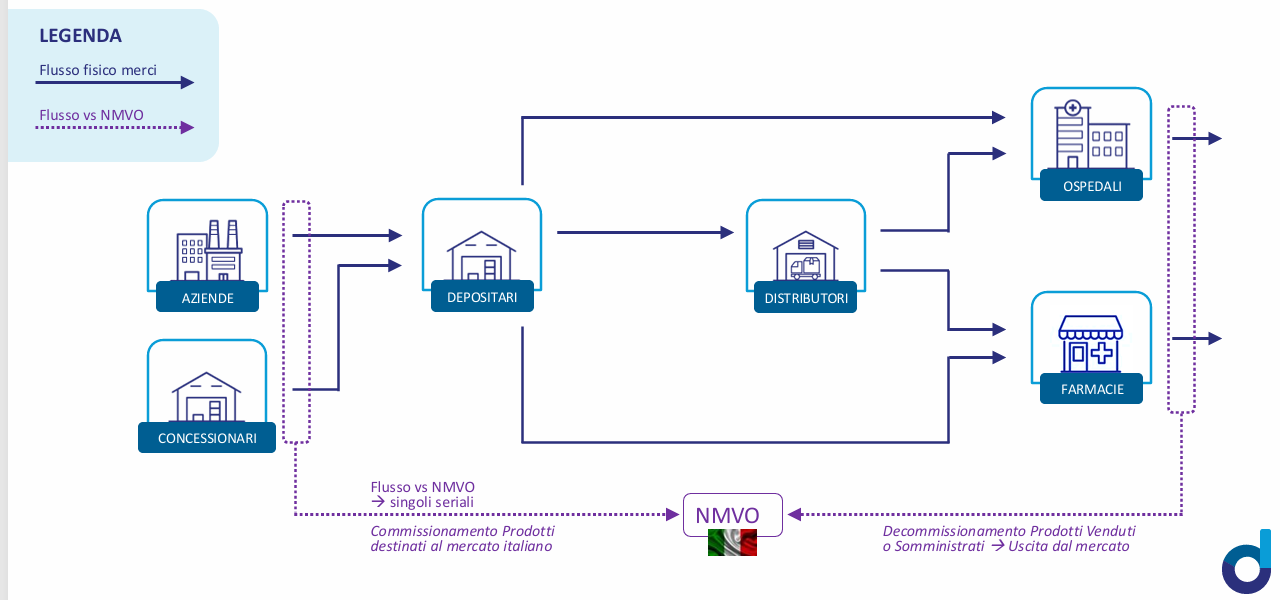
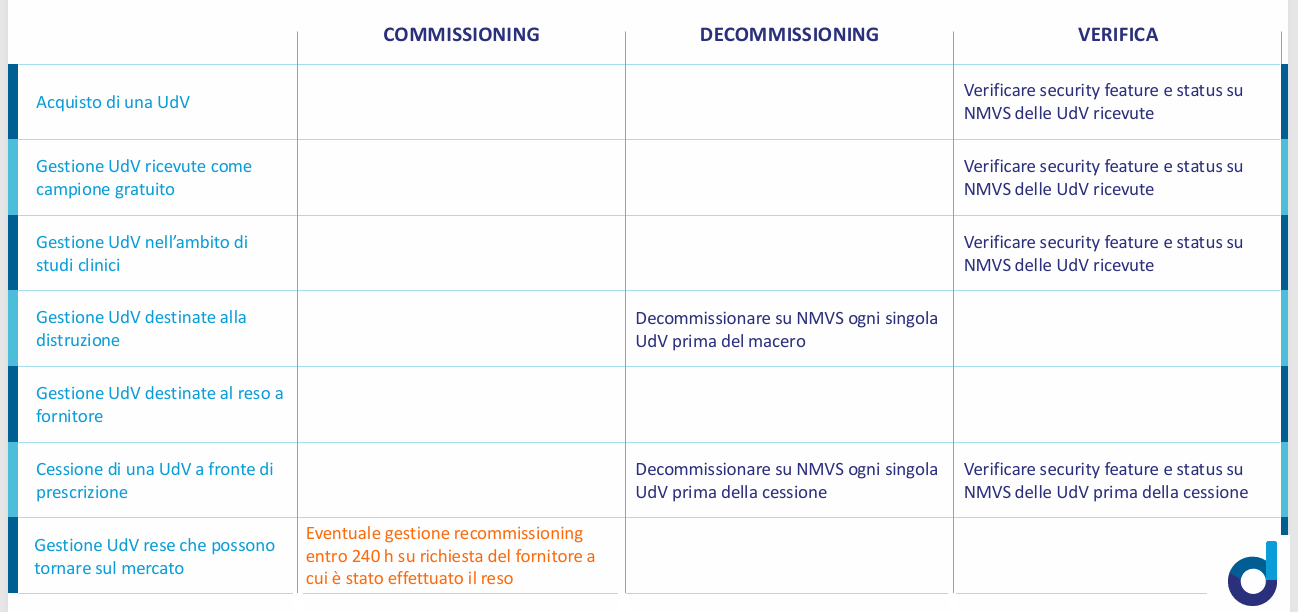
Proprio per questo motivo, i prossimi mesi dovranno servire alle farmacie (ma anche ai distributori) per prendere confidenza con un sistema di cui conoscono solo il quadro teorico. In particolare, sarà fondamentale comprendere in dettaglio “chi fa che cosa” e soprattutto “quando”. Chiarimenti in tal senso li ha forniti un convegno organizzato a Milano prima di Natale dal Consorzio Dafne: le farmacie, per esempio, dovranno verificare la corrispondenza dei codici per le confezioni in arrivo dal distributore (ma non dall’azienda farmaceutica, in caso di acquisti diretti) e “decommissionare” quando dispensano.
Ci vorrà tempo, considerato che il datamatrix è stato disegnato a Bruxelles ma la distribuzione farmaceutica italiana ha specificità tutte sue. La parte più complicata del percorso deve ancora cominciare.